Derman Zaltrap: Rêbername ji bo karanîna
Navê bazirganiya dermanê: Zaltrap
Navê Navdarkirina Navdewletî: Aflibercept
Dosage form: çareseriya înfazê ya mûzîkê
Jêdera çalak: aflibercept
Koma dermanxaneyê: tîrêja antitumor
Taybetmendiyên dermanxaneyê:
Dermanê dijber. Aflibercept proteînek fînansê ya recombinant e ku ji VEGF (faktora mezinbûna vaskularî ya endotelî) pêk tê ku parçeyên ji qadên derveyî yên rahijandinê yê VEGF 1 receptor û receptora VEGF 2 ve girêdayî ye bi qada Fc (parçeyek parçeyek kristalizer) ya immunoglobulin G1 (IgG1) ya mirovan ve girêdayî ye. Aflibercept bi karanîna teknolojiya DNA recombinant bi karanîna pergala vegotina hucreyê ovary hamster (CHO) K-1 bi kar tîne. Aflibercept glycoprotein chimeric bi giranî molekulê 97 kDa ye, glycoslasyona proteînê 15% li giraniya molekulê zêde dike, di encamê de bi tevahî mûzîka mêjî ya afliberceptê ya 115 kDa zêde dibe. Faktora mezinbûna vaskaliya endothelial A (VEGF-A), faktora mezinbûna vaskaliya endotelî B (VEGF-B) û faktora mezinbûna plîzental (P1GF) girêdayî faktorên angiogenîk ên malbata VEGF-ê ye ku dikare wekî faktorên angogenîk, kemotaktîkî û derbasbûna enfeksiyonê ya xwerû bandor bimîne ji bo hucreyên endothelial. VEGF-A di nav du receptor tyrosine kinase de - VEGFR-1 û VEGFR-2, ku li ser rûyê hucreyên endotelî dişoxilîne, tevdigere. P1GF û VEGF-B tenê bi VEGFR-1 receptor tyrosine kinase ve girêdayî ye, ku, ji bilî hebûna li ser hucreyên endothelial, di heman demê de li ser leukocytes jî heye. Activalakbûna zêde ya van receptorên VEGF-A dikare bibe sedema neovaskularîzasyona patholojîk û zêdebûna pûçbûna vaskular. P1GF di heman demê de têkildarî pêşveçûna neovaskularîzasyona patholojîk û enfeksiyonên tîrêjê ji hêla hucreyên pez ve girêdayî ye. Aflibercept wekî "trap-receptor-a" ya çareserkirî ya ku bi VEGF-A re têkildar e ji girêdana bi receptorên dayikî VEGF-A re têkildar dibe, digel vê yekê ew bi ligandsên têkildar VEGF-B û P1GF ve jî tê girêdan. Aflibercept bi damezrandina kompleksên inert ên stabîl ên ku bi çalakiya biyolojîkî nîn in bi mirovan VEGF-A, VEGF-B û P1GF ve girêdayî ye. Dibe ku wek "trap" ji bo lîgeyan çêbikin, ji nêz ve dibe ku girêdana ligandên endogjen li ser receptorên wan re têkildar bibe, û bi vî rengî veguherandina nîşanan bi van receptoran re asteng dike. Aflibercept çalakkirina receptorên VEGF û zêdebûna hucreyên endoteliyê asteng dike, bi vî rengî astengkirina avakirina keştiyên nû yên ku tumoma bi oksîjen û nesneyan peyda dike asteng dike. Aflibercept ji mirovan re bi VEGF-A ve girêdayî ye (konsepta dabeşkirina balansê (Cd) ji bo VEGF-A165 û 0.36 pmol ji bo VEGF-A121 bi pîvana 0.6 mûolol e), bi mirovê P1GF (Cd 39 pmol to P1GF-2), bi mirovan VEGF-B (CD) 1.92 pmol) bi avakirina kompleksek inert a domdar ku çalakiyek biyolojîkî ya detektîf tune.
Nîşaneyên ji bo karanîna:
Kansera kolorektal ya metastatîk (MKRP) (di nexweşên mezinan de) ku li kemoterapiya ku oxaliplatin tê de dimîne re têkildar e an jî piştî karanîna wê pêşkeftî dibe (Zaltrap bi hevahengî bi rejimek re tê de irinotecan, fluorouracil, folinate calcium (FOLFIRI)).
Contraindications:
Hîpertansiyonê li ber aflibercept an yek ji xerîdarên narkotîkê Zaltrap, xwînrijandina giran, hîpertansiyonê arterîkî, derman-berxwedan, dilêşiya kronîk a pola III-IV (klasîkirina NYHA), têkçûna giran a kezebê (tunebûna daneyan ji bo karanîna), karanîna opîtalmîkî an danasîna laşê qelew (ji ber taybetmendiyên hyperosmotic ên dermanê Zaltrap), ducaniyê, heyama şîrê dayikê, zarok û mezinan ast 18 salan (ji ber nebûna tecrubeya bes di sepanê de).Tedbîr: têkçûna giran ya gurçikê, hipertensioniya arterial, nexweşiyên girîng ên klînîkî yên pergala kardiovaskuler (CHD, çîna têkçûna dil a kronîk I-II li gorî kategoriya NYHA), temenê pêşkeftî, rewşa giştî points2 li ser pîvanê nirxandina rewşa gelemperî ya nexweş ECOG ( Koma Koma Onkolojî ya Hevbeş a Rojhilat).
Doz û rêveberî:
Zaltrap di 1 demjimêranê de wekî ivînê tête îdare kirin, li dûv wê karanîna rêza kemoterapî FOLFIRI tête bikar anîn. Dozê pêşniyazkirî ya Zaltrap bi hev re bi rêjeya kemoterapî FOLFIRI 4 mg / kg giraniya laş e. Rejîma kemoterapî ya FOLFIRI: di roja yekem a dorpêçê de - enfeksiyonê iv yekser bi rêberiya Y-şikestek irinotecan bi dozek 180 mg / m2 ji bo 90 min û fînansiyonê kalciumê (racemates çep û rast-destê) bi dozek 400 mg / m 2 ji bo 2 demjimêran. , li dû rêveberiya iv (bolus) fluorouracil bi dozek 400 mg / m2, dûv re jî dûvpêkirina hundurê berdewamî ya fluorouracil li dozek 2400 mg / m2 ji bo 46 demjimêran. certên cîkoterapiyê her 2 hefteyan dubare dikin. Pêdivî ye ku dermankirina bi Zaltrap re berdewam be heya ku nexweşî pêşve bibe an pêşvexistina toksiyonê ya bêkêfî bibîne.
Bandora alî:
Reaksiyonên neyînî yên herî gelemperî (HP) ya hemî dereceyên giran (bi rêjeyek of20%) bi kêmî 2% kêmtir in bi rejîma kemoterapî ya Zaltrap / FOLFIRI re ji ya bi rejîma kemoterapî ya FOLFIRI re (di kêmkirina rêziknameyê de): leukopenia, diyarde, neutropenia, proteinuria, zêdebûna çalakiya ACT, stomatitis, bîhnfirehî, trombocytopenia, zêdebûna çalakiya ALT, zêdebûna tansiyona xwînê, kêmbûna giraniya laş, kêmbûna lêdanê, nîskên nîskê, êşa abdominal, dysphonia, zêdebûna baldariyê serîn kreatînîn û serêş. Bi gelemperî, HP-ya jêrîn ya 3-4 giran (bi rêjeya frequency5%) hate dîtin, bi kêmîmanî 2% pir caran digel rejîma kemoterapî ya Zaltrap / FOLFIRI ji rejîma kemoterapî ya FOLFIRI (bi şertê kêmbûna bûyerê): neutropenia, diyarde, zêdebûna zexta xwînê, leukopenia, stomatitis, bîhnfirehî, proteînurîn û ashenia. Bi gelemperî, sekinandina dermankirinê ji sedema bûyera neyênî (ji hemî dereceyên giran) li 26.8% ji nexweşên ku rejîma kemoterapiyê ya Zaltrap / FOLFIRI werdigire hate dîtin ku li gorî 12.1% ji nexweşên ku rejîma kemoterapiya FOLFIRI distînin. HP-ya herî gelemperî ya ku sedema redkirina dermankirinê li in1% ji nexweşên ku rejîmaya kemoterapî ya Zaltrap / FOLFIRI werdigire asthenia / bîhnfirehî, enfeksiyonan, diyarde, dehydration, zêdebûna zexta xwînê, stomatitis, tevliheviyên thromboembolic venous, neutropenia û proteinuria bû. Rêzkirina dozê dermanê Zaltrap (kêmkirina dozê û / an kemasiyan) li% 16.7 hate kirin. Pêvekirina şertên dûrtirîn ên dermankirinê yê ku zêdetirî 7 rojan berdewam e li 59,7% ji nexweşên ku rejîme kemoterapî ya Zaltrap / FOLFIRI werdigirtin li gorî 42.6% ji nexweşên ku rejîmaya kemoterapiya FOLFIRI distînin. Mirin ji ber sedemên din, ji bilî mirinê ji pêşkeftina nexweşî, di nav 30 rojan de piştî ku cîkara paşîn a dema lêkolînê ya kemoterapî ya lêkolînkirî li 2.6% ji nexweşên ku rejîma kemoterapiyê ya Zaltrap / FOLFIRI werdigirin hat tomarkirin û di 1.0% ji nexweşên ku rejîmê kemoterapiya FOLFIRI distînin. Sedema mirinê li nexweşên ku rejîmên kemoterapiya Zaltrap / FOLFIRI werdigirin vegirtinê (di nav de septîsê neutropenîk) de li 4 nexweşan, dehydration li 2 nexweşan, hîpovolemiya li 1 nexweş, encefalopatiya metabolê li 1 nexweş, nexweşiya traktora tîrêjê (têkçûna respirasyonê ya hişk, pneumonia aspirin, û tromboembolîzma pulmonary) li 3 nexweşan, birîndarên gastrointestinal (xwînrijandin ji ulsera duodenal, ziravbûna traktora gastrointestinal, obusên bêkêmasî yên zikê) di 3 nexweşan de, mirin ji nexweşên naskirî. Li 2 nexweşan bigihîje.HP û anormaliyên laboratuarê yên di nexweşên ku bi rejîma kemoterapî ya Zaltrap / FOLFIRI têne dermankirin de têne dîtin (li gorî MedDRA) li jêr têne pêşkêş kirin. Daneyên HP-ê wekî her reaksiyonên klînîkî ya nehezkirî an alerjî di parameterên laboratîfê de hate destnîşankirin, ku pirbûna wan ji ≥2% bilind bû (ji bo HP-ya hemî asta giraniyê) di koma afliberceptê de bi koma placebo re di lêkolînek ku li nexweşên bi ICP-ê de hate kirin. Intensa HP-ya li gorî NCI CTC (Pîvana Neteweyî ya Cancer Enstîtuya Pêdivî ya Pêdivî ya Pêdivî ya Pêdeçûnê) guhertoya 3.0 hate dabeş kirin. Berfirehkirina frekansa HP (li gorî kategoriya WHO): pir caran (≥10%), pir caran (≥1% - 3 pileyên giran), pir caran mercên asthenic (degrees3 dereceyên giran), bi gelemperî - tûjkirina birînê xirab (cihêrengiya birînên birînê) , têkçûna anastomoses) (hemî asta giran û ≥3 asta giran).
Daneyên laboratîf û instrumental: pir caran - zêdebûna çalakiya ACT, ALT (hemî asta giran), kêmbûna giraniya laş (hemî asta giran), pir caran - zêdebûna çalakiya ACT, ALT ≥ 3 dereceyên giran, kêmkirina giraniya laş ≥3 asta giraniyê.
Têkiliya bi dermanên din re:
Xebatên fermî yên têkiliyên dermanan ên bi Zaltrap re nehatine kirin. Di lêkolînên bihevre de, hêjayê hebên belaş û sînordar ên di nav hev de bi dermanên din re, bi ya monoterapiyê re wekî hev bûn, ku ev yek nîşan dide ku ev kombinasyonên (oxaliplatin, cisplatin, fluorouracil, irinotecan, docetaxel, pemetrexed, gemcitabine û erlotinib) bandor li ser pharmacokine nakin. aflibercepta. Aflibercept, bi rengek din, bandor li ser pharmacokinetics irinotecan, fluorouracil, oxaliplatin, cisplatin, docetaxel, pemetrexed, gemcitabine, û erlotinib kir.
Dîroka qedandinê: 3 sal
Mercên betlaneyên dermanan: bi xilafkirinê
Contraindications
- Hîpertansiyonê ji alerjiyê an her kesê vesîrên dermanê,
- Hîpertansiyonê arterial, ne ji bo sererastkirina tibbî ye,
- kêmasiya dil a kronîk pola III-IV (klasîkirina NYHA),
- têkçûna giran a kezebê (nebûna daneya karanîna),
- Bikaranîna ophthalmîk an danasîna laşê vitrîs (bi taybetmendiyên hyperosmotîk ên dermanê re),
- heyama şîrê dayikê,
- zarok û mezinan di bin 18 saliya xwe de (ji ber kêmbûna ezmûna serlêdana guncan).
têkçûna giran a gurçikê,
- nexweşiyên girîng ên klînîkî yên pergala cardiovaskular (nexweşiya dil a koroner, têkçûna dil a kronîk I-II li gorî kategoriya NYHA),
- rewşa giştî> 2 xalên li ser pîvanê ji bo nirxandina rewşa gelemperî ya nexweşê ECOG (Koma Yekîtiya Onkolojîk a Yekbûyî ya Rojhilat).
Toawa karanîna: dosage û qursa dermankirinê
Bi navgîniyê ve ji bo 1 demjimêran a enfeksiyonê, li pey karanîna rêzimanê kemoterapî FOLFIRI.
Dozê pêşniyazkirî ya ku bi tevlihevkirina rêjeya kemoterapî ya FOLFIRI re tête 4 mg / kg giraniya laş e.
Kîmoterapiya FOLFIRI:
Di roja yekem a çikasê de - înflamasyona hundirîn a yek-însanî ya bi navgîniya Y-avek a irinotecan bi dozek 180 mg / m2 ji bo 90 hûrdem û fenomena kalsiyûmê (racemates çep-û rast-destê) li dozek 400 mg / m2 ji bo 2 demjimêran, li pey intravenous (bolus) ) danasîna fluorouracil li dozek 400 mg / m2, li dû dûvê şidandina hundurîn a berdewam a fluorouracil bi dozek 2400 mg / m2 ji bo 46 demjimêran.
Certên cîkoterapiyê her 2 hefte dubare dibin.
Pêdivî ye ku dermankirin berdewam bibe heya ku pêşveçûna nexweşî an toksiyonek nayê qebûl kirin.
Pêşniyarên ji bo sererastkirina rêzika dosandinê / derengiya dermankirinê
Pêdivî ye ku dermankirin were domandin:
- bi pêşveçûna xwîna giran,
- bi pêşveçûna perforasyona dîwarên gastrointestinal re,
- bi avakirina fistula,
- bi pêşveçûna krîza hîpertansiyonê an encephalopathyiya hîpertansiyon,
- bi pêşveçûnên tevliheviyên tromboembolîkî yên arterîkî,
- bi pêşketina sindroma nefrotîk an microangiopathiya thrombotic,
- bi pêşveçûna reaksiyonên giran ên giran (di nav de bronchospasm, tîrêj, angioedema, anaphylaxis),
- di binpêkirina dermankirina birînê de ku hewceyê mudaxeleya bijîşkî ye,
- bi pêşketina sindroma encefalopatiya posterî ya reversible (POPs), hem jî wekî leukoencefalopatiya paşverû ya paşverû (POPs) tê zanîn.
Kêmtirîn 4 hefte berî operasyona diyarkirî, divê dermankirina bi Zaltrap re bi demkî were sekinandin.
Kîmoterapiya derengî Zaltrap / FOLFIRI
Neutropenia an trombocytopenia: Divê karanîna kemoterapî ya Zaltrap / FOLFIRI bi derengî bikeve heya ku hejmara neutrofîlên di xwîna xweya jêr de zêde bibe> 1500 / μl û / an jî hejmara trombêlên di xwîna jêr de zêde bibe>> 75000 / μl.
Reaksiyonên hîpertansiyonê sivik an nerm (di nav de şilbûna çerm, rêşkirin, hişk û çerm): Pêdivî ye ku dermankirin bi demkî were rawestandin ta ku reaksiyon rawestîne. Ger hewce be, ji bo ku reaksiyona hîpertansiyonê rawestînin, gengaz e ku hûn GCS û / an antihistamines bikar bînin.
Di demjimêrên paşê de, hûn dikarin pêşgotina GCS û / an antihistamines bifikirin.
Nerazîbûnên giran ên giran (di nav de bronchospasm, dyspnea, angioedema, û anaphylaxis): Rejîma kemoterapî Zaltrap / FOLFIRI divê bê sekinandin û dermankirin ku armanca rawestandina reaksiyonê hîpertansiyonê divê bê paşve xistin.
Postkirina dermankirinê bi Zaltrap û birêkûpêkkirina dozê
Zêdebûna tansiyona xwînê: Pêdivî ye ku hûn bi karanîna dermanê bi demkî rawestînin heya ku hûn bigihîjin zêdebûna tansiyona xwînê.
Bi pêşkeftina dubare ya zêdebûna zexta xwînê re, bikaranîna derman divê were rawestandin heya ku kontrola li ser zêdebûna tansiyona xwînê bi dest bixe û di cûrbecûrên paşê de dozaja wê kêm bike 2 kg / kg giraniya laş.
Proteinuria: Pêdivî ye ku karanîna narkotîkê ji bo proteinuria> 2 g / rojê bête sekinandin, vesazkirina dermankirinê mimkun e piştî kêmkirina proteînuria ji 2 g / rojê;; karanîna Zaltrap divê were rawestandin heya ku proteînuriya% 20 kêm bibe), bi kêmî ve 2% di dema karanîna rejîmê kemoterapî de Zaltrap. / FOLFIRI ji bi rêjeya kemoterapî ya FOLFIRI re (di kêmkirina rêziknameyê de): leukopenia, diyarde, neutropenia, proteinuria, zêdebûna çalakiya ACT, stomatitis, bîhnfirehî, trombocytopenia, zêdebûna çalakiyê ALT, zêde tansiyona xwînê, kêmbûna kîloyan, kêm xwarinê, epistaxis, êşa zik, dysphonia, zêdebûna giranîya Tuan creatinine û serêş.
HP-ya jêrîn 3-4 bi giranî herî zêde hate dîtin (bi bez>> 5%), bi kêmî ve% 2 caran di sepandina rêzimanî ya kemoterapî ya Zaltrap / FOLFIRI de ji dema ku karanîna rejîmaya kemoterapî ya FOLFIRI (ji bo kêmkirina rêjeya şidandinê): neutropenia, diyarde, zêdebûna zexta xwînê, leukopenia, stomatitis, bîhnfirehî, proteînurîn û ashenia.
Bi gelemperî, sekinandina dermankirinê ji sedema bûyera neyênî (ji hemî dereceyên giran) li 26.8% ji nexweşên ku rejîma kemoterapiyê ya Zaltrap / FOLFIRI werdigire hate dîtin ku li gorî 12.1% ji nexweşên ku rejîma kemoterapiya FOLFIRI distînin.
HP-ya herî gelemperî ya ku sedema betalkirina terapiyê li> 1% ji nexweşên ku rejîmaya kemoterapî ya Zaltrap / FOLFIRI werdigirtin asthenia / bîhnfirehî, enfeksiyonan, diyarde, dehydration, zêdebûna tansiyona xwînê, stomîtît, komplîkasyonên thromboembolîk venoz, neutropenia û proteinuria bû.
Rêzkirina dozê (kêmkirina dozê û / an kêmasiyan) di% 16.7 de hate kirin. Pêvekirina şertên dûrtirîn ên dermankirinê yê ku zêdetirî 7 rojan berdewam e li 59,7% ji nexweşên ku rejîme kemoterapî ya Zaltrap / FOLFIRI werdigirtin li gorî 42.6% ji nexweşên ku rejîmaya kemoterapiya FOLFIRI distînin.
Mirin ji ber sedemên din, ji bilî mirinê ji pêşkeftina nexweşî, di nav 30 rojan de piştî ku cîkara paşîn a dema lêkolînê ya kemoterapî ya lêkolînkirî li 2.6% ji nexweşên ku rejîma kemoterapiyê ya Zaltrap / FOLFIRI werdigirin hat tomarkirin û di 1.0% ji nexweşên ku rejîmê kemoterapiya FOLFIRI distînin. Sedema mirinê li nexweşên ku rejîmên kemoterapiya Zaltrap / FOLFIRI werdigirin vegirtin bû (di nav de septîsê neutropenîkî) li 4 nexweşan, dehydration li 2 nexweşan, hîpovolemia li 1 nexweş, encefalopatiya metabolîk li 1 nexweş, nexweşîya rêçê ya respirasyonê (têkçûna respirasyonê ya hişk, pneumonia aspirin) û embolîzma pulmonary) li 3 nexweşan, birîndarên gastrointestinal (xwînrijandin ji ulcerê duodenal, ziravbûna traktora gastrointestinal, dorpêçkirina gumrikê ya bêkêmasî) li 3 nexweşan, encamek fatal ji naskirî. sedemên eşkere di 2 nexweşan de.
HP û anormaliyên laboratuarê yên di nexweşên ku bi rejîma kemoterapî ya Zaltrap / FOLFIRI têne dermankirin de têne dîtin (li gorî MedDRA) li jêr têne pêşkêş kirin. Daneyên HP-ê wekî her reaksiyonên klînîkî ya nehezkirî an alerjî di parameterên laboratîfê de hate destnîşankirin, ku pirbûna wan ji> 2% bilind bû (ji bo HP ya hemî dereceyên giraniyê) di koma afliberceptê de bi koma placebo re di lêkolînek ku li nexweşên bi ICP-ê de hat kirin de hate diyar kirin. Intensa HP-ya li gorî NCI CTC (Pîvana Neteweyî ya Cancer Enstîtuya Pêdivî ya Pêdivî ya Pêdivî ya Pêdeçûnê) guhertoya 3.0 hate dabeş kirin.
Rêzkirina Freya HP (li gorî kategoriya WHO): pir caran (> 10%), bi gelemperî (> 1% - 0,1% - 0,01% - 3 pileyên giran).
Ji pergala xwînê û lînfatîk: pir caran - leukopeniya (hemî dereceyên giran û> 3 pileyên giran), neutropenia (hemî asta giran û> 3 asta giraniyê), thrombocytopenia (hemî astên giran), pir caran - nepoxa febrile ya hemî asta giraniyê û> 3 dereceyên giran, thrombocytopenia> 3 asta giran.
Li ser beşa pergala nesneyî: bi gelemperî - reaksiyonên giran (hemî dereceyên giran), kêm caran - reaksiyonên hîpertansiyonê> 3 dereceyên giran.
Ji alîyê metabolîzm û vexwarinê: pir caran - kêmbûna rûnê (hemî dereceyên giran), bi gelemperî - dehydration (hemî dereceyên giran û>> 3 dereceyên giran), windakirina lêdanê> 3 asta giraniyê.
Ji alîyê pergala nervê ve: pir caran - serêş (ji her dereceya giran), bi gelemperî - serêş> 3 dereceyên giran, kêm caran - sindroma encefalopatiya paşverû ya paşverû (SARS).
Ji pergala kardiovaskulayî: pir caran - zêdebûna zexta xwînê (ji hemî dereceyên giran) (di 54% ji nexweşên ku bi zêdebûna tansiyona xwînê re> 3 derece ji giraniyê, zêdebûna zexta xwînê ya ku di nav du cildên pêşîn ên dermankirinê de pêşve çû), xwînrijandin / xwînê (hemî derece hişkbûn), celebê herî gelemperî ya xwînrêjî ji şûştinên piçûk ên nokêşî ne (1-2 dereceyên giran), bi gelemperî tevliheviyên thromboembolîk ên arterial (ATEO) (wek bêbexşinên cerebrovaskulîkî yên akût, di nav de êrîşên iskemîkî yên cerebrovaskal ên derbazbûyî, angina pectoris, thrombus intracardiac, infoktion myocardial, thromboembolism arterial and colitis ischemic) (hemî asta giraniyê), tevliheviyên thromboembolîk venous (VTEO) (tromboza venêrana kûr û embolîzma pulmonary) ya hemî pileyên giran, xwînê> 3 sal bi giranî, bi giranî tevî xwîna gastrointestinal, hematuria, xwînê piştî prosedurên bijîşkî, dubarebûna nediyar - di nexweşên ku Zaltrap digirin, pêşkeftina hemorrajiya giran û dilşikestiya pulmonaryê hate ragihandin. ny / hemoptysis, tevî ku bi encamek mirinê.
Ji pergala respirasyonê: pir caran - kurtbûna tûj (ji her dereceya giran), bêhnvedanên nazik (ji hemî dereceyên giran), dysphonia (ya hemî astên giran), pir caran - êşa di oropharynx (hemî dereceyên giran), rhinorrhea (tenê 1-2 rhinorrhea) hate dîtin giran), hindik - bêhêzî> 3 pileyên giran, bêhnvedan> 3 pileyên giran, dysphonia> 3 pileyên giran, êşa di oropharynx> 3 dereceyên giran.
Ji pergala digestive: pir caran - diyarde (hemî dereceyên giran û> 3 pileyên giran), stomatitis (hemî asta giran û> 3 pileyên giran), êşa abdominal (hemî dereceyên giran), êşa di jorîn de (hemî dereceyên giran) , bi gelemperî - êşa abdominal> 3 pileyên giran, êşa giran di jorîn>> 3 dereceyên giran, hemorroîd (hemî astên giran), xwînê ji reaksiyonê (hemî astên giran), êşa di rektumê de (hemî astên giran), êşa diranê ( hemî dereceyên giran), stomatîtîzmê ya bihêz (hemî asta giraniyê bixwin), avakirina fistulas (anal, pîvaza piçûktir-urîn, derveyî hindik-çerm ya piçûk, çerm-kolonîkî-vejîn, nav-devî) (hemî dereceyên giran), bêbext - avakirina fistulên gastrointestinal> 3 astên giran, perforasyona dîwarên xweya gastrointestinal ya hemî ast û û 3 pileyên giran, di nav de perforasyonên mirinê yên dîwarên xweya gastrointestinal, xwîna xwînê ji reşê> 3 dereceyên giran, stomatîzma şahîn> 3 dereceyên giran, êşa di rektumê de> 3 dereceyên giran.
Ji çerm û tehsên xwerû: pir caran - sindroma erythrodysesthesiya palm-plantar (hemî dereceyên giran), bi gelemperî - hyperpigmentation çerm (hemî astên giran), sindroma erythrodysesthesia palm-plantar> 3 asta giraniyê.
Ji pergala urînê: pir caran - proteînurya (li gorî daneyên klînîkî û laboratîfê yên hevbeş) (hemî dereceyên giran), zêdebûnek di zêdebûna serayê de kreatinîn (hemî dereceyên giran), bi gelemperî - proteinuria> 3 astên giran, bi gelemperî - sindroma nefrotîk. Ji 611 nexweşên ku derman bi rejîma kemoterapiya Zaltrap / FOLFIRI re werdigirin yek bi nexweşînek proteînurîn û zêdebûna zexta xwînê bi mîkroangiopatiya trombotîk hat nasîn.
Reaksiyonên gelemperî: pir caran - şertên asthenic (hemî dereceyên giran), hestek lerizînê (hemî asta giran û> 3 asta giran), bi gelemperî - şertên asthenic (> 3 astên giran), kêm caran - bêhna birîna bêsînor (dudilbûna perdeyên birînê, têkçûna anastomoses ) (hemî astên giran û>> 3 pileyên giran).
Daneyên kedkar û amûr: gelek caran - zêdebûna çalakiya ACT, ALT (hemî dereceyên giran), kêmbûna giraniya laş (hemî astên giran), pir caran - zêdebûna çalakiya ACT, ALT> 3 pileyên giran, giranbûna giran> 3 asta giraniyê.
Pirbûna reaksiyonên neyînî di komên nexweşên taybetî de
Di nexweşên pîr de (> 65 salî), êşê diyarde, dizî, ashenia, kêmkirina giran û dehydration ji% 5 zêdetir bû li gorî nexweşên temenek biçûk. Nexweşên pîr divê bi baldarî ji bo geşepêdana diyardeyê û / an dehdayîna mimkun bêne şopandin.
Di nexweşên ku kêmasiya fonksiyonê ya rengek sivik de di dema destpêkirina narkotîkê de, bûyera HP-ê li gorî dema ku dest pê kiriye de bi wan re ne bi nexweşiyên bêyî hebûna renal heye. Li nexweşên bi kêmbûna rengek nerm û hişk, hebûna HP-ne-renal bi gelemperî bi ya ku di nexweşên bêyî têkçûna renal de heye, ji bilî zêdebûna bexşîna dehydration (ya hemî dereceyên giran) bi> 10% kêm e.
Mîna hemî dermanên proteîn ên din, aflibercept xwedan xeterek potansiyonê ya immunogenîsiyonê ye. Bi gelemperî, li gorî encamên hemî ceribandinên klînîkî yên onkolojîk, yek ji wan nexweşan titek bilind a jibo antîpîldîdê nîşan nedaye.
Li ser ewlehiya girtina Zaltrap di dozên ku zêdetirî 7 mg / kg di carekê de her 2 hefte ne an 9 mg / kg yek carekê her 3 hefteyan carekê tune. HP-ya herî hevpar a ku digel van rejîmên dermankirinê de tê dîtin wek HP-ya ku bi bikaranîna derman re di dozên dermankirinê de hatî dîtin re wekhev bû.
Ji bo derman nabe antîdotek taybetî heye.Di rewşa zêde dozek de, nexweşan hewceyê dermankirina piştevaniyê dikin, bi taybetî çavdêrîkirin û dermankirina hîpertansiyonê arterial û proteînuria. Pêdivî ye ku nexweş bi baldarî were şopandin da ku her HP were nasandin û çavdêr kirin.
Rêbernameyên taybetî
Berî ku dest bi dermankirinê bikin û berî destpêka her cîvaka nû ya dermankirinê bi aflibercept, tê pêşniyar kirin ku testek xwîna gelemperî ya bi destnîşankirina formulasyona leukocyte pêk were.
Bi pêşkeftina yekem a nehperopeniya> 3 pileyên hişkbûnê, divê karanîna dermankirî ya G-CSF were hesibandin, ji bilî vê, di nexweşên ku xetera zêdebûna pêşkeftinên neutropenîk de zêde bûne, danasîna G-CSF ji bo pêşîlêgirtina neutropenia tê pêşniyar kirin.
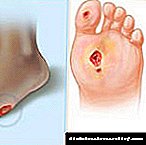
Divê nexweşan bi berdewamî ji bo nîşan û nîşanên gastrointestinal û xwîna giran ên din werin şopandin. Aflibercept nabe ku bi nexweşên giran re were derman kirin.
Nexweşan divê ji bo nîşan û nîşanên perforasyona dîwarên gastrointestinal têne kontrol kirin. Di rewşa başbûnê ya dîwarên gastrointestinal de, dermankirina bi aflibercept-ê divê were qut kirin.
Bi pêşveçûna fistulas, dermankirina bi aflibercept re divê were sekinandin.
Di dema dermankirinê de bi aflibercept, tê pêşniyar kirin ku her 2 hefteyan zexta xwînê kontrol bikin, di nav de çavdêriya tansiyona xwînê jî berî damezrandina aflibercept, an bi gelemperî li gorî nîşanên klînîkî di dema dermankirinê de bi aflibercept. Di dema zêdebûna tansiyona xwînê de di dema dermankirinê de bi aflibercept, divê terapiya guncaw antihîpertensiyon were bikar anîn û zexta xwînê bi rêkûpêk were şopandin. Bi zêdebûna zexta xwînê re, pêdivî ye ku tedawiya bi afliberse re were rawestandin heya ku tansiyona xwînê bigihîje nirxên armancê, û di cûrbecûrên paşê de, divê dozê aflibercept bi 2 mg / kg were kêm kirin. Di rewşa pêşveçûna krîza hîpertansiyonê an encefalopatiya hîpertansiyonê de, divê rêveberiya dermanê dermanê bê sekinandin.
Dema ku Zaltrap li ser nexweşên ku xwediyê patolojiya kardînaskar a derûnî, mîna nexweşiya dil a koroner û bêhêziya dil e, divê hişyar be. Ne ceribandinên klînîkî yên rêveberiya narkotîkê li ser nexweşên bi têkçûna dil a çîna fonksiyonel III û IV li gorî kategoriya NYHA tune.
Heke nexweş ATEO pêşve bike, divê tedawiya bi aflibercept were qutkirin.
Berî her rêveberiya aflibercept, divê proteînurîn bi karanîna nîşana testê ya nîşanker an bi destnîşankirina rêjeya proteîn / kreatînîn di mîzê de were destnîşankirin da ku pêşveçûn an zêdebûna proteînurîzasyonê bibîne. Nexweşên ku di urînê de xwedî rêjeyek proteîn / kreatînîn> 1 divê di mîzê rojane de qala proteînê were diyar kirin.
Bi pêşveçûna sindroma nefrotîk an microangiopathiya thrombotic, divê dermankirina bi aflibercept were bête qutkirin.
Di bûyera reaksiyonek giran ya hîpertansiyonê ya giran (di nav de bronchospasm, dyspnea, angioedema û anaphylaxis), dermankirin divê bê paşve xistin û dermankirina guncaw ku armanca rawestandina van reaksiyonan e divê were dest pê kirin.
Di rewşê de reaksiyonek hîpertansiyonê ya sivik a ku ji aflibercept (di nav de hyperemia çerm, rash, urticaria, pruritus), dermankirin divê bi demkî were sekinandin heya ku reaksiyon çareser bibe. Heke ji hêla klînîkî pêdivî ye, corticosteroids û / an antihistamines têne bikar anîn ku van reaksiyonan rawestînin. Di demjimêrên paşê de, hûn dikarin pêşgotina GCS û / an antihistamines bifikirin. Dema ku dermankirin ji nû ve dest pê dike ji bo nexweşên ku berê reaksiyonên hîpertansiyonê bûn, pêdivî ye ku hişyar be, ji ber ku divê Di hin nexweşan de, digel pêxemberîtiya wan, tevî bikaranîna corticosteroids, re-pêşveçûna reaksiyonên hîpertansiyonê hate dîtin.
Bikaranîna aflibercept divê herî kêm 4 hefte piştî mudaxeleyên giran ên sereke were rawestandin û heya ku birîna derman bi tevahî were qenc kirin. Ji bo mudaxeleyên hûrgelan ên giran, wek sazkirina kîtreyek venous a navendî, biopsî, derxistina diran, tedawiya bi aflibercept dikare piştî ku birîna kedî bi tevahî baş kiribe dest pê bike.Di nexweşên birîna kêmbûna kêmbûnê de ku pêwistî bi destwerdana bijîşkî heye, divê karanîna aflibercept were rawestandin.
POPs dikare bi guhartinek di rewşa derûnî, sepandinên epîleptîk, birîn, vereşîn, serêş û tengasiyên dîtbarî de werin xuyang kirin. Diagnostîkirina LUTS bi skeletek MRI ya mêjî ve piştrast e. Di nexweşên bi POPs de, karanîna aflibercept divê bê sekinandin.
Nexweşên pîr (> 65 salî) bi xetereya zêdebûna şilbûn, dizî, asthenia, kêmkirina giran û dehydration. Ji bo kêmkirina rîskê, pêdivî ye ku nexweşên weha ji bo tespîtkirina zû û dermankirina zû nîşana û nîşanên xerîb û dehdayînê bi çavdêriya bijîşkî bi baldarî hewce ne.
Nexweşên ku xwedan indexek rewşa giştî> 2 xalên (li ser pîvana nirxandina pênc-0-xala ji ECOG ya Koma Onkolojiya Hevbeş a Rojhilat) an ku bi nexweşiyên hevbeş cidî hene dikarin rîskek mezintir a encama klînîkî ya neyînî hebe û hewceyê çavdêriya bijîşkî ya hişyar a ji bo tespîtkirina zû ya xirabbûna klînîkî.
Zaltrap çareseriyek hyperosmotîk e, pêkanîna kîjan berhev e ku bi danasîna hundurê intraocular re têkildar e. Derman nikare nav laşê zîhniyetê bikeve.
Di derbarê bandora Zaltrap de li ser şiyana ajotinê an çalakiyên din ên potansiyel ên xeternak, ti lêkolîn nehatiye kirin. Heke nexweşan nîşanên ku vîzyona wan û qeweta lêhûrbûna wan bandor dikin, û her weha reaksiyonên psîkomotor jî hêdî dikin, pêdivî ye ku pêdivî bi nexweşan were şîret kirin ku ji ajotina ajotinê û çalakiyên potansiyel ên din dûr nebin.
Pêşînbûn û laktasyon
Di derbarê jinên afrîkî de daneya bikaranîna aflibercept nayê zanîn. Di lêkolînên ceribandî de, bandorên embryotoxic û teratogenic aflibercept di heywanan de hate eşkere kirin. Ji ber ku angiogenesis ji bo geşepêdana embriyoyê xwedî girîngiyek mezin e; girtina angiogenesis bi karanîna Zaltrap re dibe ku ji bo pêşveçûna ducaniyê bandorên negatîf bîne. Bikaranîna dermanê di dema ducaniyê de bi kontra dikeve.
Divê jinên temenê zarokbûnê bi wan re were şêwirîn ku di dema dermankirinê de bi Zaltrap re nehiştin. Divê ew di derbarê îhtîmala bandorên neyînî yên dermanê li ser fetusê de agahdar bibin.
Jinên temenek mezin û zilamên pîrbûyî divê di nav dema dermankirinê de rêbazên bi bandorker ên nakokkirinê bikar bînin û herî kêm 6 meh piştî ducana paşîn a dermanê.
Di dema dermankirina bi afliberceptê de xeterek zerarê di mêran û jinan de heye (li ser bingeha daneyên ku di lêkolînên ku li ser monkey hatine kirin de, di mêran û mêran de ku ji wan ve dibe sedema kêmbûna zikakîbûnê, bi tevahî piştî 8-18 hefteyan vedigerin).
Lêkolînên klînîkî tune ku ji bo bandorên Zaltrap-ê li ser hilberîna şîrê şîrê, veqetandina aflibercept bi şîrê dayikê, û bandora dermanê li ser pitikan binirxînin.
Nayê zanîn ka afreta bi şîrê dayikê di jinan de çi tê derxistin. Lêbelê, ji ber ku ne gengaz e ku meriv jêderê dorpêçê di şîrê şîrê de derxe, û her weha îhtîmal e ku reaksiyonên ciddî yên ku aflibercept dikare di nav pitikan de çêbibe, pêdivî ye ku yan ji şîrê dayikê red bikin an ne karanîna Zaltrap ( li gorî giringiya bikaranîna dermanê ji bo dayikê re).
Peywendî
Xebatên fermî yên têkiliyên dermanan ên bi Zaltrap re nehatine kirin.
Di lêkolînên berhevdanê de, hêjayê guncaneyên serbixwe û sînorkirî yên di berhevdana bi dermanên din re, di heman demê de, bihevrebûna aflibercept bi monoterapî re bû, ku ev nîşan dide ku ev berhevok (oxaliplatin, cisplatin, fluorouracil, irinotecan, docetaxel, pemetrexed, gemcitabine, û erlotinib) bandor nakin. pharmacokinetics of aflibercept.
Klasîkirina nosolojîk (ICD-10)
| Kombûna ji bo çareseriyê ji bo vegirtinê | 1 ml |
| madeya çalak: | |
| aflibercept | 25 mg |
| Excipients: dihydrogen fosphate natrium monohydrate - 0,5774 mg, fosfate natrium natrium - heptahydrate - 0.2188 mg, monohydrate acid citric - 0.0443 mg, citrate sodium dihydrate - 1.4088 mg, chloride sodium - 5.84 mg, 0.1 M çareseriya hîdrochlorîk çareseriya hîdroksidî ya sodium an 0,1 M - heta pH 5.9-6.5, sucrose - 200 mg, polysorbate 20 - 1 mg, avê ji bo şiyariyê - heta 1 ml |
Pharmacodynamics
Aflibercept proteînek fusion a recombinant e ku ji girêdanê ve ye VEGF (faktora mezinbûna endotelî ya vaskalfaktorên mezinbûna vaskulînê ya endotelî) parçeyên domên jêzêde yen jînekuşeşer ê VEGF-1 û VEGF-2 bi domaina Fc re têkildar e (parçeyek qehremanî ya kristînîbûnê) IgG1 kes.
Aflibercept bi karanîna teknolojiya DNA recombinant bi karanîna pergala vegotina hucreyê ovary hamster (CHO) K-1 bi kar tîne.
Aflibercept glycoprotein chimeric bi giranî molekulê 97 kDa ye, glycoslasyona proteînê 15% li giraniya molekulê zêde dike, di encamê de bi tevahî mûzîka mêjî ya afliberceptê ya 115 kDa zêde dibe.
Faktora mezinbûna vaskaliya endotelelî A (VEGF-A), faktora mezinbûna vaskaliyê ya endotelî B (VEGF-B) û faktora mezinbûna placental (PLGF) têkildar in VEGF- malbatek faktorên angiogenîk ku dikarin wek hucreyên mîkogenîk, kemotaktîkî û permeabilasyona vaskalê ya bihêz ji bo hucreyên endotelî çalak bikin. Alakî VEGF-A bi du tirosîn kînasan ve tête girtin - VEGFR-1 û VEGFR-2 li ser rûyê hucreyên endothelial tê de ne. Plgf û VEGF-B tenê bi receptor tyrosine kinase ve girêdin VEGFR-1, ku, tewra ku li ser astê hucreyên endotelî ye, li ser leukocytes jî heye. Activalakbûna zêde ya van receptoran VEGF-A dibe ku bibe sedema neovaskularîzasyona patholojîk û zêdebûna permeasiyonê vaskular. Plgf di heman demê de têkildarî pêşveçûna neovaskolîzasyona patholojîk û enfeksiyonên tîrêjê jî ji hêla hucreyên pez ve girêdayî ye.
Aflibercept wekî receptorek xalîçeya çareserkirî ya ku bi hev ve girêdide tevdigere VEGF-A bi girêdanek mestir ji receptorên dayikê VEGF-Aji bilî vê, ew jî girêdanên bi ligands ve girêdayî ye VEGF-B û Plgf. Aflibercept bi mirov re têkildar e VEGF-A, VEGF-B û Plgf bi damezrandina kompleksên bêkêr ên bêdawî yên ku ne çalakiya biyolojîkî ne. Ji ber vê yekê wek nêçîrvanek ji ligands re têkildar dibe, pêşîgirtina girêdana ligands endogjenê li ser receptorên wan ên têkildar û bi vî rengî nîşana di navbera van receptoran de asteng dike.
Aflibercept çalakkirina receptor asteng dike VEGF û mezinahiya hucreyên endotelî, bi vî awayî çêkirina keştiyên nû yên ku tumor bi oksîjen û nesneyan peyda dike asteng dike.
Aflibercept re têkildar e VEGF-A mirov (hevsengiya hevsengiyê ya domdar (Cd) - 0.5 pîvole ji bo VEGF-AJi bo 165 û 0.36 pmol VEGF-A121), s Plgf kes (cd 39 pmol ji bo Plgf-2), s VEGF-B mirov (cd 1.92 pîvol) bi avakirina kompleksek bêdawî ya bêpergal ku çalakiyek biyolojîk a ku nayê diyar kirin heye.
Bikaranîna afliberceptê di mîzan de bi kansên xenograft an allograft, mezinbûna cûrbecûr adenocarcinoma asteng dike.
Li nexweşên bi kansera kolorektal metastatîk (MKRP) ku berê bi kemoterapiya ku bi oxaliplatin-ê ve tê derman kirin (bi an bêyî rêveberiya berê ya bevacizumab) hatî dermankirin, rejîma kemoterapî Zaltrap ® /FOLFIRI (fluorouracil, irinotecan, folinate kalcium) bi zêdebûna statîstîkî ve girîngiya hêviya jiyanê li gorî rêjeya kemoterapî nîşan da FOLFIRI.
Pharmacokinetics
Nêzîkbûnê Di lêkolînên preklînîkî yên li ser modelên tumor de hatine kirin, dozên biyolojîk ên aktîvekirinê yên têkildar bi dozên ku hewce ne ji bo afirandina hebên aflibercepta azad a ku di tîrêjiya pergalê de dişoxilîne de, bi hev re têkildar bûn, ji zêdebûna amûrên afliberceptê yên ku di navbêna pergalê de têkildar in. VEGF. Concentrations ku di tixûbê pergalê de têkildar in VEGF aflibercepta bi zêdebûna dozê re heya piraniya wan zêde dibe VEGF ne girêdayî ne.A zêdebûnek din a dozê ya aflibercept dibe sedema zêdebûna dozê-a ku di asta tevgera afliberbesta azad a ku di tixûbê pergalê de dihesibîne û tenê bi hinekî zêdebûnek din a hûrbûnê ya ku têkildar dibe VEGF aflibercepta.
Li nexweşan, Zaltrap every bi 2 mg / kg iv her 2 hefteyan tê dersînorkirin, di dema vê yekê de zêdebûna bahozê ya kêmbûna afliberse ya serbest di derheqê mîqyasa afliberceptê ya têkildar de heye. VEGF.
Di dozek pêşniyazkirî de 4 mg / kg carekê her 2 hefte, hêjahiya hêjayî ya afliberceptê azad nêzî nirxên C bess di çerxa dermanê duyemîn de bi pratîkî re tune qewimîn (bihevdana 1.2% di navhevsaziyê de, lihevhatina bi mezinahiya afliberceptê ya yekbûyî ya yekem de lihevhatî hate dîtin).
Belavkirin. Vss aflibercepta belaş 8 lître ye.
Metabolîzm. Ji ber ku aflibercept proteînek e, lêkolînên li ser metabolîzma wê nayên kirin. Tê payîn ku Aflibercept dê di nav peptidên piçûktir û amînoyên yekane de veqetîne.
Zehfkirin. Afliberbesta belaş a ku di dorhêla pergalê de digire bi piranî têkildar e VEGF-familî bi damezrandina kompleksên neçareser ên domdar. Tê payîn ku, mîna proteînên din ên mezin yên têkildarî VEGF û aflibercept free dê hêdî hêdî ji mêjûya pergalê bi rêgezên biyolojîk ên din, wek katalolîzma proteolîtîk ve were rakirin.
Di dozên ku zêdetirî 2 mg / kg derbas dibin de, zelalbûna afliberceptê ya belaş 1 l / rojê bi T-ya dawî bû1/2 6 roj
Proteînên giran ên mêjî yên mêjî ji hêla kêzikan ve nayên derxistin, ji ber vê yekê tê pêşbînîkirin ku şîreta rengek bi rengek kêm be.
Linearity / nonlinearity of elimination. Di têkiliyê de bi girêdana mebesta aflibercept-ê heya hedefa xwe (endogjen VEGF) aflibercept free li dozên li jêr 2 mg / kg kêmbûnek bilez (ne-xerîdar) di tîrêjên wê de di tixûbê pergalê de, ku bi eşkere têkelbûna wê ya têkildar bi endogjenî ve têkildar nîşan da. VEGF. Di nav dozê de ji 2 heta 9 mg / kg, zelalbûna afliberbestê ya xêzik xalî dibe, dibe ku ji ber mekanîzmayên biyolojîk ên vexwarinê ya razdar, wekî kabolîzma proteînê.
Komên nexweşên taybetî
Zarok. Bi ser / danasîna dermanê Zaltrap ® re di dozên 2, 2.5, 3 mg / kg her 2 hefteyan de. 8 nexweşên zarokî yên bi tîrêjên zexmî (temenê 5 û 17 salî) ne, navînî T1/2 aflibercept free, ku piştî dozana yekem tê destnîşankirin, bi qasî 4 roj (3 ji 6 roj).
Nexweşên pîr. Age bandoriya pharmacokinetics ya aflibercept nake.
Zayend Tevî cudahiyên di zelalbûna aflbesta belaş û V ded di mêr û jinan de, cudahiyên di zayend de di têkiliya pergalê wê de ne hate dîtin dema ku di dozek 4 mg / kg de hate sepandin.
Indeksa girseya laş. Girseya laş bandor li ser paqijkirina aflibercept a belaş û V kird Bi vî rengî, di nexweşên ku giraniya laşê wan ji zêdetirî 100 kg e, zêdebûna zêdebûna pergala pergalî ya afliberceptê ji hêla 29% ve hate dîtin.
Girêdana nijadî. Nijadî û etnîkî bandor li ser pharmacokinetics ya aflibercept bandor nekir.
Bi têkçûnê. Lêkolînên fermî li ser karanîna Zaltrap li nexweşên kêmbûna kezebê nehatiye kirin.
Di nexweşên bi nermî de (hebûna bilirubînê ya bi tevahî di xwînê de ≤1.5 VGN li her nirxên çalakiya ACT) û navîn (hebûna bilirubînê ya total di xwînê> 1.5–3 VGN li her nirxên çalakiya ACT), têkçûna kezebê ti guhertin di nav zelaliya aflibercept de nîşan da. . Di derheqê pharmacokinetics of aflibercept de di nexweşên bi kansera hepatîkek giran (tevliheviya bilirubin a xwînê> 3 VGN di nirxên çalakiya ACT de tune) tune.
Têkçûna renal. Lêkolînên fermî li ser karanîna Zaltrap li nexweşên bi kêmasiya gurçikê nehatiye kirin.
Di ceribandina pergalî ya (AUC) ya afrodîta belaş de di nexweşên ku bi rengek cûrbecûr ê giran rehikan de dema ku Zaltrap using di dozek 4 mg / kg de bikar tînin, tu cûdahî çênebû.
Pêşînbûn û laktasyon
Di derbarê jinên afrîkî de daneya bikaranîna aflibercept nayê zanîn. Lêkolînên di heywanan de bandora embryotoxic û teratogenic di aflibercept de diyar kir. Ji ber ku angiogenesis ji bo pêşkeftina embriyo xwedî girîngiyek mezin e, sekinandina angiogenesis bi rêveberiya Zaltrap dikare ji bo pêşveçûna ducaniyê bandorên neyînî çêdike. Di dema ducaniyê de karanîna Zaltrap û li jinên ku ducanî dibe nayê pêşniyar kirin.
Pêwîst e ku jin di temenên xwedîkirinê de şîret bikin ku di dema dermankirinê de bi Zaltrap pregnancy re ducaniyê dûr bikin, û divê ew di derbarê îhtîmala bandorên neyênî yên Zaltrap ® li ser fetusê de agahdar bibin.
Jinên temenek mezin ên zayînê û mêranên fêrbûyî divê di dema dermankirinê de rêbazên bi bandor ên nakokbûnê bikar bînin û herî kêm 6 meh piştî dermana paşîn a paşîn.
Di dema dermankirinê de bi afliberceptê ve heye ku di mêr û jinan de zayîna kêmbûnê hebe (li gorî daneyên ku di lêkolînên ku li ser monkey hatine kirin de, di mêran û mêran de ku ji wan re dibe sedema fetisîna belengaz, bi tevahî piştî heftê 8-18-an venehatî ye).
Lêkolînên klînîkî ji bo nirxandina bandora Zaltrap ® li hilberîna şîrê dayikê, serbestberdana aflibercept di şîrê dayikê û bandora wê de li ser pitikan nehatiye meşandin.
Nayê zanîn ka ka aflibercept di şîrê dayikê de çewa ye. Lêbelê, ji ber ku ne gengaz e ku meriv heyberê têkeve hundirê şîrê diya xwe, û her weha gengaziya pêşkeftina reaksiyonên ciddî yên ku ji hêla afliberceptê ve di pitikan de têne derxistin, ne gengaz e ku hewce ne ku ji şîrê dayikê veqetînin an ne karanîna Zaltrap ® (girêdayî girêdayî. giringiya karanîna dermanê ji bo dayikê).
Bandorên aliyê
Reaksiyonên neyînî yên herî gelemperî (HP) (ji hemî dereceyên giran, bi daxistinek ≥20%), bi kêmî ve% 2 caran tê sepandin dema ku serîlêdana kemoterapî Zaltrap /FOLFIRIji rejimek bi kemoterapî re FOLFIRIHP-ya jêrîn bûn (ji ber kêmbûna bûyerê): leukopenia, diarre, neutropenia, proteinuria, zêdebûna çalakiya ACT, stomatitis, bîhnfirehî, trombocytopenia, çalakiya ALT zêde, zêdebûna zexta xwînê, kêmkirina giraniya laş, kêmbûna lêdanê, nîskên şikestî, êşa abdominal, dysphonia, zêdebûna zêdebûna serîn kreatinîn û serêş.
HP ya herî giran a giraniya 3-4 pileyî (bi berekariya ≥5%), bi kêmî ve% 2 caran tê sepandin dema ku serîlêdana kemoterapî Zaltrap /FOLFIRI digel rejîmên kemoterapiyê FOLFIRIHP-ya jêrîn bûn (di kêmkirina rêziknameyê de kêm bûn): neutropenia, diyarde, zexta xwînê ya zêde, leukopenia, stomatitis, bîhnfirehî, proteinuria û ashenia.
Bi gelemperî, sekinandina dermankirinê ji ber bûyerên neyînî (ji hemî dereceyên giran) li 26.8% ji nexweşên ku rejim kemoterapî yê Zaltrap distînin receiving /FOLFIRI, li gorî 12.1% ji nexweşên ku rejimên kemoterapiyê digirin FOLFIRI. HP ya herî gelemperî, ku sedem ji bo redkirina dermankirinê di ≥1% ji nexweşên ku rejîme kemoterapî yê Zaltrap received /FOLFIRIbûn: asthenia / bîhnfirehî, enfeksiyonan, diyarde, dehydration, zêdebûna zexta xwînê, stomatitis, tevliheviyên thromboembolîk venous, neutropenia û proteinuria.
Rêzkirina dozê dermanê Zaltrap ® (kêmkirina dozê û / an qutbûnê) di% 16.7 de hate kirin. Pêvekirina şertên paşîn ên terapiyê ku 7 rojan ji wan re dirêjtir e li 59,7% ji nexweşên ku rejîme kemoterapî yê Zaltrap distînin observed /FOLFIRIligel 42.6% ji nexweşên ku rejîmek kemoterapiyê digirin FOLFIRI.
Mirin ji ber sedemên din, ji bilî pêşkeftina nexweşî, ku di nav 30 rojan de piştî şûnda dawîn a rêzimanî ya kemoterapî ya lêkolînkirî hatî dîtin, li 2.6% ji nexweşên ku rejimên kemoterapî yê Zaltrap receiving /FOLFIRI, û di% 1 ê nexweşên ku rejîmek kemoterapiyê digirin FOLFIRI. Sedema mirina nexweşên ku digihîje rejîma kemoterapî Zaltra /FOLFIRIbûn: enfeksiyonê (di nav de sepsisê neutropenîk) li 4 nexweşan, dehydration li 2 nexweşan, hîpovolemiya li 1 nexweş, encephalopatiya metabolê li 1 nexweş, nexweşiya traktora respirasyonê (têkçûna respirasyonê ya akût, pneumonia aspirinê û embolism pulmonary) li 3. nexweşan, bêserûberiya birînên gastrointestinal (xwînrijandin ji ulsera duodenal, pezîna giyayê gastrointestinal, obusên bêkêmasî yên zikê) di 3 nexweşan de, mirin ji sedemên nenas li 2 nexweşan.
Li jêr HP û anormaliyên nirxên laboratîfê li nexweşên ku rejîme kemoterapî yê Zaltrap receiving /FOLFIRI bi dabeşkirina wan li dersên pergalê-organan li gorî kategoriya ferhengê bijîjkî ya ji bo çalakiyên birêkûpêk MedDRA.
HP-yên ku li jêr hatine pêşkêş kirin wekî her reaksiyonên klînîkî ya nehezkirî an alerjî di parameterên kedê de bi frequency 2% frekuendê mezintir (ji bo HP ya hemî dereceyên giraniyê) di koma afliberceptê de li gorî koma placebo di lêkolînek ku li nexweşên bi ICP-ê hatiye kirin de hate destnîşankirin. Ziraviya HP-ê li gorî dabeşkirin bû NCI CTC (Pîvanên Termînolojiya Navneteweyî ya Enstîtuya KanserêWeqfa Pêdivî ya Topavêjiyê ya Enstîtuya Neteweyî ya Neteweyî ya Neteweyên Yekbûyî) guhertoya 3.0.
Bûyera HP-ê li gorî kategoriya WHO wekî jêrîn hate destnîşankirin: pir caran - ≥ 10%, pir caran - ≥1– incl. Giran ≥3).
Li ser pergalên xwînê û lînfatîk: pir caran - leukopeniya (ji her germahiya giran, tevî asta rd3-yê giran), neutropenia (ji her astê giran, tevî asta including3-ya giran), thrombocytopenia (hemî asta giran), pir caran - neutropeniya febrile (ji hemî pileyên giran, tevî degree 3 pileya giran), thrombocytopenia (degree3 asta giran)
Ji pergala bêpergalî: bi gelemperî - reaksiyonên hişmendiyê (hemî asta giran), bi gelemperî - reaksiyonên hîpertansiyonê (giraniya rd3).
Nexweşîyên metabolîkî û nermalayî: pir caran - kêmbûna rûn (hemî dereceyên giran), bi gelemperî - dehydration (hemî asta giran û degree3 asta giran), kêmbûna rûnê (giranbûna degree3).
Ji pergala nervê: bi gelemperî - serêşek (ji hemî asta giraniyê), bi gelemperî - êşek (≥3 asta giran), kêm caran - POP.
Ji rezberan: pir caran - zêdebûna zexta xwînê (ji hemî dereceyên giran) (di 54% ji nexweşên ku zêdebûna tansiyona xwînê de (degree3 pileya giran), zêdebûna zexta xwînê ya ku di du cûrên pêşîn ên dermankirinê de pêşve çû), xwînrêjî / xwînê (ji hemî dereceyên giran), Cûreyek herî gelemperî ya xwînê birînên piçûktirîn ên nokîn (1-2 giran), bi gelemperî tevliheviyên thromboembolîk ên arterial (ATEO) (wek qezayên cerebrovaskulîkî yên tûjî, tevî êrîşên ishemîkî yên cerebrovaskularî yên derbasbûyî, angina pectoris, intracardiac t ombus, enfeksa myocardial, thromboembolism arterial û colitis ischemic) (hemî asta giran), tevliheviyên thromboembolîk venous (thrombosis venus kûr û embolism pulmonary) ya hemî astên giran, xwîna xwînê (degree3 asta giran, carinan jî fatal), tevî gastrointestinal - xwîna xwînê, hematurya, xwînrijandin piştî prosedurên bijîşkî, beredayî naskirî ye - di nexweşên ku Zaltrap receiving digirin, pêşkeftina hemorrajiya giran a intracranial û hemorrajiya pulmonary / hemoptîsê hate ragihandin, i.e. . felaket.
Ji pergala respirasyonê, laş û organên mediastinal: pir caran - şilbûn (ji her dereceya giran), bêhnvedanên nazik (ji hemî dereceyên giran), dysphonia (ji hemî dereceyên giran), pir caran - êşa di oropharynx (hemî dereceyên giran), rhinorrhea (rhinorrhea tenê 1-2 hişmendî hate dîtin) , bi gelemperî - şilbûn (şerta giranbûna ≥3), nîskên nîzîkî (degree3 pileya giran), dysphonia (degree 3 pileya giran), êşa di oropharynx de (degree3 asta giran).
Ji birîna gastrointestinal: bi gelemperî - xerîbî (ji her dereceyên giran (tevî giraniya rd3)), stomatit (ji her astê giran, tevî giraniya rd3-yê giran), êşa abdominal (ji hemî giraniyên giran), êşa di barka jorîn (hemî astên giran), gelemperî - êşa şikestî ≥3 pileya giran, êşa li jorîn di jorîn de ((3 pileya giran), hemorroîd (hemî astên giran), xwînê ji rektumê (hemî dereceyên giran) , êşa di rektumê de (hemî dereceyên giran), êşa diranê (hemî asta giraniyê), stomîtîtîsîzmê (hemî astên giran), dîmen fistulas (anal, devika piçûktir-urînî, hundurê piçûk ên piçûktir (çermê piçûk-piçûk), zincîra mezin-devkî, navber-devkî) (hemî dereceyên giran), kêm caran - avakirina fistulên gastrointestinal (giranbûna ≥3), perforasyona dîwarên gastrointestinal (hemî Asta giranbûnê, di nav de pileya giranbûna ≥3), di nav de perforasyona mirinê ya dîwarên xweya gastrointestinal, xwîna xwînê ji rektumê (degree3 pileya hişkbûnê), stomatîtîzma aphthus (degree 3 pileya giran), êşa di rektumê de ( Giran ≥3).
Li ser perçê çerm û pişkiya pişikê: pir caran - sindroma erythrodysesthesia palm-plantar (hemî asta giran), bi gelemperî - hyperpigmentation çerm (hemî astên giran), sindroma erythrodysesthesia palmar-plantar (giraniya 3).
Ji gurçikê û kaniya urînê: pir caran - proteinuria (li gorî daneyên klînîkî û laboratîfê yên hevbeş) (hemî dereceyên giran), zêdebûnek li seranserê zêdebûna kreatînîn (seranserê giran), pir caran - proteinuria (degree3 asta giran), kêm caran - sindroma nefrotîk. Yek ji nexweşan bi proteînurîn û zêdebûna zexta xwînê ji 611 nexweşên ku bi rêjîmê kemoterapî Zaltrap têne dermankirin ® /FOLFIRI, bi mîkroangiopatiya trombotîz hate tespît kirin.
Nerazîbûn û reaksiyonên gelemperî li cîhê injeksiyonê: pir caran - şertên asthenic (hemî astên giran), hestek dilêşiyê (hemî asta giran, tevî ≥ 3 pileya giran), pir caran - şertên asthenic (≥3 pileya giran), pir caran - başkirina birîna bêhêz ( cudahiya birînên birînê, têkçûna anastomoza) (hemî dereceyên giran, tevî degree3 asta giraniyê jî).
Daneyên laboratîf û instrumental: pir caran - zêdebûna çalakiya ACT, ALT (hemî dereceyên giran), kêmbûna giraniya laş (hemî asta giraniyê), pir caran - zêdebûna çalakiya ACT, ALT (asta sêyemîn ya giran), kêmbûna giraniya laş (asta sêyemîn ya giran) .
Hêjeya HP-ê di komên nexweşên taybetî de
Pîr. Di nexweşên pîr de (≥ 65 sal), êşê diyarde, dizî, asthenia, windakirina giran û dehydration ji% 5 zêdetir ji yên di nexweşên temenek biçûk de ne. Nexweşên pîr divê bi baldarî ji bo geşepêdana diyardeyê û / an dehdayîna mimkun bêne şopandin.
Têkçûna renal. Di nexweşên ku kêmasiya rengek nermîn di dema destpêkirina karanîna Zaltrap de ye, bûyera HP-ê bi ya ku di dema destpêkirina karanîna Zaltrap de ji wan re di nexweşanên ku fonksiyonek renal de neçar e, bi wî re qayîm e. Di nexweşên bi kêmbûna rengek nerm û giran de, bûyera HP-ne-renal bi gelemperî ji ya ku di nexweşên bêyî kêmasiya renal de heye, bi şertê>> 10% rêjeya dehydration ya zêde (hemî dereceyên giran) bi vî rengî re lihevhatî ye.
Bêmokbûnê Mîna hemî dermanên proteîn ên din, aflibercept xwedan xeterek potansiyonê ya immunogenîsiyonê ye.Bi gelemperî, li gorî encamên hemî ceribandinên klînîkî yên onkolojîk, yek ji wan nexweşan titek bilind a jibo antîpîldîdê nîşan nedaye.
Bikaranîna derman-paş-kirrûbirra
Ji dil: frequency naskirî - têkçûna dil, kêmbûna parçebûna derziyê ya ser masiya çepê.
Ji alîyê masûlkeyên skeletal û pêveka pêvek: frequency nedîtî - osteonecrosis of jaw. Di nexweşên ku aflibercept digirin de, dozên osteonecrosisê ya jaw, bi taybetî di wan nexweşên ku hin faktorên rîskê hene ji bo osteonecrosisê nofûsê, wek mînak, karanîna bisphosphonates û / an prosedurên diravî yên invasive.
Dosage û rêveberî
V, di forma înfuzyonê ya 1-demjimêran de li dû danasîna rejîmek kemoterapî FOLFIRI. Dozê pêşniyazkirî ya Zaltrap, bi rengek kemoterapîparêzî tête heval kirin FOLFIRI4 mg / kg ye.
Rejeya kemoterapî FOLFIRI
Di roja yekem a çikolatê de - înflamasyona iv hevdemî bi navgîniya Y-arek a irinotecan bi dozek 180 mg / m 2 ji bo 90 min û fenomena kalsiyûmê (racemates çep û rast-destê) bi dozek 400 mg / m 2 ji bo 2 h, s rêveberiya paşê ya iv (bolus) ya fluorouracil li dozek 400 mg / m 2, li dû dûvê şidandina hundurîn a berdewam a fluorouracil a li dozek 2400 mg / m 2 ji bo 46 demjimêran
Certên cîkoterapiyê her 2 hefte dubare dibin.
Dermankirina bi Zaltrap ® heya ku pêşveçûna nexweşiyê an pêşveçûna berbiçûna berbiçav nayê qebûl kirin.
Pêşniyarên ji bo sererastkirina rêzika dosandinê / derengiya dermankirinê
Dermankirina bi Zaltrap ® re divê di rewşên jêrîn de bê paşve xistin:
- pêşveçûna xwîna giran,
- pêşkeftina perforasyona dîwarên gastrointestinal,
- pêşveçûna krîza hîpertansiyonê an encephalopatiya hypertensiyon,
- pêşkeftina tevliheviyên tromboembolîkî yên arterial,
- pêşkeftina sindroma nefrotîk an microangiopathiya thrombotic,
- pêşkeftina reaksiyonên giran ên giran (di nav de bronchospasm, tîrêj, angioedema, anaphylaxis),
- binpêkirina başkirina birînê, hewcedariya destwerdana bijîşkî,
- pêşkeftina sindroma encefalopatiya posterî ya paşverû (POP), ku wekî leukoencefalopatiya paşverû ya paşverû (POPs) jî tê zanîn.
Kêmtirîn 4 hefte berî operasyona diyarkirî, dermankirina bi Zaltrap divê bi demkî were sekinandin.
| Kêmotrapiya derengî Zaltrap / FOLFIRI | |
| Neutropenia an thrombocytopenia | Bikaranîna rejima kemoterapî Zaltrap /FOLFIRI Pêdivî ye ku bêne paşve xistin ta ku hejmara neutrofîlên di xwîna jêr de zêde bibe ≥1.5 · 10 9 / l û / an jî hejmara trombîlên di xwîna jêrxanî de nekeve to75 · 10 9 / l |
| Reaksiyonên hîpertansiyonê sivik an nerm (di nav de şûjina çerm, rash, hişk û çerm) | Pêdivî ye ku dermankirin bi demkî were rawestandin ta ku reaksiyon qut bibe. Ger hewce be, ji bo ku reaksiyona hîpertansiyonê rawestînin, gengaz e ku hûn GCS û / an antihistamines bikar bînin. Di demjimêrên paşê de, hûn dikarin pêşgotina GCS û / an antihistamines bifikirin |
| Reaksiyonên giran ên giran (di nav de bronchospasm, pişikê, angioedema, û anaphylaxis) | Rejîma kemoterapî Zaltrap ® / divê bê paşde xistinFOLFIRI û dermankirina dermankirinê bi mebesta rawestandina reaksiyonê hîpertansiyonê |
| Deftera dermankirina bi Zaltrap ® û birêkûpêkkirina dozê | |
| Di zêdebûna tansiyona xwînê de | Pêdivî ye ku meriv bi karanîna dermanê Zaltrap susp heya ku kontrola zêdekirina tansiyona xwînê bi dest xwe ve were rawestandin rawestandin. Bi pêşkeftina dubare ya zêdebûna tansiyona xwînê re, pêdivî ye ku bikaranîna derman were rawestandin heya ku kontrola zêdekirina tansiyona xwînê bi dest bixe û, di heyamên paşê de, doza Zaltrap reduce bigihîje 2 mg / kg. |
| Proteinuria (binêre "Rêbernameyên taybetî") | Bikaranîna Zaltrap ® ji bo proteînuriya g2 g / roj rawestînin, dermankirin dikare ji nû ve çêbibe ku piştî kêmkirina proteînurîn li ® heya proteînuriya ® kêm dibe |
| Sindroma hişk ya stomatitis û palmar-plantar erythrodysesthesia | Doza bolus û înfazasyona fluorouracil divê ji% 20 kêm bibe |
| Xwarzê giran | Dozê irinotecan divê ji hêla 15-20% kêm bibe. Heke diyardeya hişk dubare dibe, pêdivî ye ku çerxa paşîn ji hêla 20% ve zêdebûna dozaja bolus û enfusion of fluorouracil kêm bike. Heke diyardeya giran berdewam be û kêmbûna dozên her du dermanan bikar bînin, karanîna wan biqedînin FOLFIRI. Ger hewce be, dermankirina bi dermanên antidiarrheal û nûvekirina windahiyên liquid û electrolyte dikare were kirin. |
| Neptropeniya Febrile û sepsisê neutropenîk | Di demjimêrên paşîn de, divê dozê irinotecan% 15-20% kêm bibe. Bi pêşveçûna dubare di cûrbecûrên paşîn de, ducana bolus û enfeksiyonê ya fluorouracil divê ji% 20 kêmtir be. Pêdivî ye ku serîlêdana G-CSF were hesibandin. |
Ji bo bêtir agahdarî li ser ziyanê irinotecan, fluorouracil û folinate calcium, li ser rêberên karanîna wan bibînin.
Komên nexweşên taybetî
Zarok. Di nexweşên zarokî de ewlehî û bandorkerî nehatiye saz kirin.
Di lêkolînek ewlehî û toleransê de bi zêdebûna dozê re, 21 nexweşên ji 2 heta 21 salî (temenê navîn 12,9 sal) bi tîrêjên zexm Zaltrap ® di dozên ji 2 heta 3 mg / kg iv her 2 hefteyan de wergirtin. Paradîgmayên pharmacokinetîkî yên afrandina davêjê li 8 ji van nexweşan (ji 5 û 17 salî salî) ve hatin nirxandin: Li Pharmaokinetics binêrin, jêr. "Komên nexweşên taybetî". Doseya herî zêde ya tolerans di lêkolînê de dozek 2.5 mg / kg bû, ku ji dozek ewle û bandorker ji bo mezinên bi kansera kolorektal a metastatîk kêmtir bû.
Nexweşên pîr. Nexweşên pîr hewceyê dravkirina Zaltrap ne hewce ne.
Bi têkçûnê. Lêkolînên fermî li ser karanîna Zaltrap li nexweşên kêmbûna kezebê nehatiye kirin. Li ser bingeha daneyên klînîkî, eşkerebûna pergalî ya afliberceptê di nexweşên bi kêmasiya kezebê sivik û nerm ji heman rengî di nexweşên bi karûbarê normal ya kezebê de bû.
Delîlên klînîkî diyar dikin ku pêdivî ye ku birêkûpêkkirina dozê li afliberceptê li nexweşên bi kêmbûna kezebê sivik û nerm hewce neyê kirin.
Di derheqê karanîna afliberceptê de li nexweşên bi giraniya hepatîkên giran hebî tune.
Têkçûna renal. Lêkolînên fermî li ser karanîna Zaltrap ® li nexweşên ku bi rengek kêmasiya rengek ve nehatiye vebirin. Li ser bingeha daneyên klînîkî, derketina pergalî ya afliberceptê di nexweşên bi kêmasiya rengek nerm û nerm ji heman rengî di nexweşên bi fonksiyona renal ya normal de bû.
Delîlên klînîkî diyar dikin ku sererastkirina doza destpêkê ya afliberceptê li nexweşên bi kêmasiya rengek nerm û nerm hewce nake. Di derheqê karanîna dermanê de di nexweşên ku bi rengek têkçûna giran a renal de gelek daneyên pir kêm hene hene, ji ber vê yekê divê di dema bikaranîna dermanê di nexweşên weha de hişyar be.
Pêşniyarên ji bo amadekirina çareseriyan û danasîna wan
Pêdivî ye ku derman di bin çavdêriya bijîşkî de bi kar bîne û bi kar bîne dermanên kevneperest.
Konservatorê nehfirî nexin. Iv bi devikan (ne bi lez û ne jî hêdî bi cih bînin).
Zaltrap ® ji bo rêveberiya intravitreal nayê armanc kirin.
Mîna tevahiya amadekariyên parantal, berî îdarekirinê, çareseriya dilandî ya Zaltrap ® ji bo hebûna parçeyên nedilxwaz an discolorasyonê divê xuyang bibe.
Divê çareseriyên Ziltrap Dil yên dilkêş bêne bikar anîn bi karanîna setên enfeksiyonê IV ku ji PVC ve têne çêkirin diethylhexyl fhthalate (DEHP), PVC ku DEHP nabe, lê di nav xwe de trioctyltrimellate (TOTM), polypropylene, PE, ku di hundurê PVC de, polurethane vekirî tê rêve kirin.
Kitsên enfeksiyonê yên IV divê bi filtreyên polethersulfone re bi pîvana pore 0.2 mîkron hebe. Li fîlên polyvinylidene fluoride (PVDF) an naylon bikar neynin.
Ji ber kêmbûna lêkolînên lihevhatinê, Zaltrap ® nabe ku bi dermanên din an solvents ve were hev kirin, ji bilî çareseriya 0.9% chloride sodium û çareseriya dextrose 5%.
Amadekirinê ya çareseriya enfeksiyonê û wergirtinê
Solutionareseriya înfazê ya dermanê Zaltrap divê ji hêla pizîşkek bijîşkî ve di şertên aseptîk de li gorî prosedurên desteserkirina ewle were amadekirin.
Heke çareseriya pêzanê di nav xwe de dabeşên nedilxwaz pêk bîne an guhertinek di rengê wê de hebe, bi şîretê bi dermanê re bikar neynin.
Divê konteynirên enfeksiyonê yên ji PVC-ê hatine çêkirin ku DEHP an pololefin (bêyî PVC û DEHF) hene bikar bînin.
Tenê ji ber enfeksiyonê intravenous ji ber hyperosmolarity (1000 mosmol / kg) ya Zaltrap ® mûzîdê.
Derman ne ji bo înşeatê di laşê zîhnî de ye.
Pêdivî ye ku balonê dermanê Zaltrap bêhn be. Zaltrap ® mîqdara hewceyê ya zaltrap Remove derxînin û bi navgîniya hewceyê bi 0.9% çareseriya klorîd natriumê ji bo enzûnê an 5% çareseriya dextrose ji bo înşeatê bigirin.
Pîvana afliberceptê ya di nav çareseriya înfuzyonê de piştî ku merasima Zaltrap uting were rijandin divê di navbera 0,6–8 mg / ml de be.
Ji nêrînek mîkrobiolojîk, divê çareseriya dilşikestî ya Zaltrap immediately tavilê were bikar anîn, aramiya fizîkî û kîmyewî ya wê heta 24 saetan di germahîya 2–8 ° C û heta 8 demjimêran li germahîya 25 ° C de bimîne.
Vitalên dermanê Zaltrap ji bo karanîna yekane têne armanc kirin. Divê her dermanê bikarbînî ya ku di sîrê de bimîne divê li gorî pêdiviyên têkildar ên Rûsyayê were veqetandin. Piştî ku pêdivî ji serî ve hatî vexandin vekişîna venêlê dîsa nekin.
Pir zêde doz kirin
Li ser ewlehiya girtina Zaltrap ® di dozên ku zêdetirî 7 mg / kg yek carekê de her 2 hefte ne an 9 mg / kg yek carekê di 3 hefteyan de carekê tune.
Nîşan HP-ya herî hevpar a ku digel van rejîmên dozkirinê de tê dîtin wek HP-ya ku bi dermanên di dermanên dermankirinê de hatî dîtin re wekhev bû.
Derman: dermankirina başkirinê pêwîst e, bi taybetî çavdêrîkirin û dermankirina zêdebûna tansiyona xwînê û proteinuria. Ji bo Zaltrap no ne antîdotek taybetî heye. Nexweş divê di bin çavdêriya bijîjkî ya nêzîk de be da ku HP-ya ku di beşa "Bandora Side" de tête naskirin û çavdêr kirin.
Forma berdanê
Kişandin ji bo çareseriyê ji bo enfeksiyonê, 25 mg / ml. 4 ml ya narkotîkê di şûşek gûzê rengîn (tîpa I) de, bi kîtekek bermotîzek bromobutyl bi kapasîtek cûrbecûr a aluminium re, bi tîpek stalle û dîskek sekinandinê. 1 an 3 fl. di navberek kartonan de. 8 ml ya narkotîkê di şûşek gûzê rengîn (tîpa I) de, bi kîtekîtek gomlekî bromobutyl bi kapasîteya amûr a aluminium re, bi tîpek stalle û dîskek sekinandinê. 1 fl. di navberek kartonan de.
Rêbernameyên ji bo karanîna Zaltrap
Jêdera çalak: aflibercept 25 mg
Excipients: fosphate natrium monohydrate (E339), natrium natrium fosphate heptahydrate (E339), monohydrate acid citric (E330), sodium citrate dihydrate (E331), chloride sodium sodium chloride, sucrose, Polysorbate 20 (E433), acid hydrochloric 36% (E507), sodium acid (E524), avê ji bo şiyariyê.
Danasîn Zelalek rengek zerîn a rengîn an zer a zer, ji zirarên mekanîk bêpar be.
Danasîna derman

Derman ji koma tiryakê antitumor re girêdayî ye. Ew bi rengek mestiranê tête çêkirin, ji navnîşana ku ji bo çareseriyê vegirtî têne amadekirin. Navê ne-xwedîtiyê yê navneteweyî tête pejirandin. Navên bazirganî Zaltrap û Eilea ne.
Nîşaneyên ji bo karanîna
Di heman demê de, dozek diyar a fenomena folînîk, irinotîkan û fluorouracil tê girtin. Hemî van pêkhateyan ji bo kemoterapiyê di nexweşên ku bi kansera colorectal dimînin têne bikar anîn, dema ku ew ji sazûmanên din ên antitumor re berxwedanek mezin nîşan dide. Her weha, "Zaltrap" ji bo relaksî tête bikar anîn.

Actionalakiya dermankolojîkî ya aflibercept
Di bin bandora afliberceptê de, receptorên ku avakirina xweyên nû yên xwînê ji bo vexwarinê peyda dikin û mezinbûna tumor zêde dikin, çalakiyê dikin. Ji ber ku rast e ku xwîn têr nebe, neoplazm hêdî hêdî di mezinahiyê de kêm dibe, hucreyên atypîkî dev ji perçebûn û mezinbûnê berdin.

Agahdariya ku meriv çawa metabolîzma proteîna aflibercept pêk tê tune ye. Zanyar pêşniyar dikin ku ew di nav asîdên amînoyî û peptîdan de dabeş dibe. Hêmana aktîv ji şeş rojan bi laşê bi laş ve tê derxistin. Gurçikan beşdarî vekişîna fonan nakin.
Rêbernameya ji bo karanîna "Zaltrap"
Derman bi qasî saetekê tê şûştin. Dosne li 4 mg per kîlo laşê laş tê hesibandin. Rejima kemoterapî wê wekî:
- Di roja yekem a dermankirinê de, katekerek Y-ê tête bikar anîn, bi alîkariya ku kîjan enfeksiyonên intravenoz têne çêkirin bi irinotecan re di navhev de bi 180 mg per meter çargoşe têne kirin. Pêvajoyî 90 hûrdem berdewam dike. Calcium folinate ji bo du demjimêran li dozek 400 mg û heman dravê fluorouracil tê rêvebirin,
- Usionnfazê ya din dê 46 demjimêran berdewam be. Di vê rewşê de, fluorouracil di xalek 2400 mg de tête rêve kirin.
Ev ceribandina dermankirinê her du hefteyan carek tê dubare kirin. Ji bo kesên bi şekir, divê dosage hewce neyê guhertin.
Divê enfeksiyonek ji hêla bijîşkek ku di pratîka kemoterapî de xwedî tecrûbe ye were kirin.

Di forma nişankirî de û bi jet, divê derman di tu rewşê de neyê derman kirin.
Berî karanîna, çareserî bi baldarî tê kontrol kirin. Pêdivî ye ku ew bêyî şikên bêkêşkirî bêne xuyang kirin.
Di dema infusions de fîlterên nylon an polvinylidene fluoride bikar nakin.
Ji ber ku di derheqê kombînasyona dermanê bi dermanên din de agahiyek tune, tenê kombînasyona narkotîkê bi çareseriya klorîdek sodium an dextrose tête destûr kirin.
Tenê bijîjkek pêdivî ye ku ji bo rêveberiya intravenous çareseriyê amade bike, bi rêgezên asepsisê çav digire. Ma fîşekek ku tê de parçeyên nedilxwaz hene an rengê dermanê hatî guhertin bikar neynin. Piştî rûkulkirinê, pîvandina guncanê divê li herêma 0,6–8 mg / ml be. Pêdivî ye ku dermanê qedandî di cih de bikar bîne, ji ber ku parastina aramiya laşî û kîmyewî tenê di rojê de dikare were dîtin.
Ku çêtir e ku "Zaltrap" bikirin, bihayê wê û hilanîn
Hûn dikarin li dermanxaneyek derman bikirin. Ji bo vê bikin, hûn hewce ne ku şîreta bijîjkî peyda bikin. Bêyî wê, firotina dermanan derveyî ye. Buhayê yek dermanek narkotîkê ji 8500 rubl e.

Pêdivî ye ku derman di odeyê de be ku germahiya wan ji 8 ne bilindtir be û ji 2 pileyan jî nizmtir be. Divê derman bi tavê rasterê tavê nebe.
Hûn dikarin ji roja hilberînê sê sal derman bigire. Piştî bidawîbûna vê heyamê, hûn nekarin tiryakê bikar bînin, ji ber vê yekê pêdivî ye ku were rakirin.
Reviews li ser "Zaltrap"
"Saltrap" bi bavê min re derman kir. Ev dermanek baş e, ew bi bandorker li dijî kanserê tevdigere, lê bandorên alî her dem çêdibe. Baş e ku ew her du hefteyan carekê ew injeksiyonê dikin, ji ber ku bav pir dijwar bû ku kemoterapî zirardar kir. Lê analîzan nîşan da ku neoplazm kêm dibe.
Piştî danasîna Zaltrap, serê min hertim aciz bû, bêhn û bêhnvedan hebû, ez bi berdewamî dixwest ku razêm. Lê derman pir zû bandorê li tumorê dike. Ji ber vê yekê, ji bo ku hûn encamek baş bistînin, hûn dikarin teng bikin.
Her çend derman gelek biha ye û rewş piştî ku tirsnak e, lê ew bi rastî jî dibe alîkar. Bi alîkariya çend qursan, min bi pratîkî ji tumê derxistim. Doktor dibêjin ku şansê zewqê ji paşvedanê heye. Berî vê dermanê, ez ji hêla kesên din dihatin dermankirin, lê bandora wan ji bo demek kurt dom kir. Piştî Zaltrap, çend salan min nîşanên kanserê tune.
Ger hûn wê yekê binirxînin û wê li ser tevngehên civakî parve bikin, em ê pir sipasdar bin
Form û pêkve berdan
Kanîzma ku ji wan re çareserî ji bo enfalê hatî amadekirin. Vials xwedî 4 ml û 8 ml. Hêjeya maddeya sereke ya afliberceptê 25 ml di 1 ml de ye. Vebijarka duyemîn, çareseriyek sterekî amade ye ku ji bo rêveberiya intravenoz tê armanc kirin. Rengê rengê çareseriyê zelal e an jî bi tînahiya zer-zer heye.
Hêmana bingehîn proteîneya aflibercept e. Dezgeh: fosfatek natrium, acid citric, acid hydrochloric, sucrose, chloride sodium, hîdroksid sodium, ava.
Aflibercept xebata receptorên, yên ku berpirsiyar damezrandina perçeyên nû yên xwînê yên ku tumor dişewitînin berpirsiyar digirin û di mezinbûna wê ya zirav de beşdar dibin. Dibe ku bêyî vexwarinê xwînê bimîne, neoplazm dest pê dike ku li mezinahiyê kêm bibe. Pêvajoya mezinbûnê û dabeşkirina hucreyên wê yên atypîkî rawestîne.
Aflibercept çalakiya receptoran asteng dike, ku berpirsiyar damezrandina perdeyên nû yên xwînê ne.
Bi lênihêrîn
Monitoringavdêriya domdar a rewşa tenduristiyê li nexweşên bi kêmasiya renal, hîpertansiyonê arterial, nexweşiya dil a koroner, û qonaxên destpêkê yên têkçûna dil hewce dike. Bi hişyarî, derman ji bo nexweşên pîr û bi rewşek tenduristî ya gelemperî re tê derman kirin, heke pîvana dengdanê ji 2 pûanan zêde nebe.
Zaltrap çawa bigirin?
Rêvebirîya navîn - 1 demjimêra înfazê. Dosaya navînî 4 mg per kîloya giraniya laş e. Dermankirin li ser bingeha rejîmek kemoterapî tête îmzekirin:
- roja yekem ya dermankirinê: enfeksiyonê intravenous bi kîtekek Y-rengî ku Irinotecan 180 mg / m² 90 hûrdeman bikar tîne, folateya kalciumê ji bo 120 hûrdem li dozek 400 mg / m² û 400 mg / m² Fluorouracil,
- enfeksiyonê domdar piştê 46 demjimêran bi dozek Fluorouracil 2400 mg / m².
Rêvebirîya navîn - 1 demjimêra înfazê.
Cycleîçek her 14 rojan carekê dubare dibe.
Pesta gastrointestinal
Dirêj, êşa abdomînisê ya bi cûrên cûrbecûr, pêşveçûna hemorroyê, damezrandina fistulên di anus, bladder, zikê piçûk de. Acheşa diranê ya gengaz, stomîtît, êşa di rektumê de, derziyê. Fistulên di pergala jêgirtinê de û başkirina dîwaran kêm caran pêk tê, ku dikare bibe sedema mirina nexweş.
Nîşaneyên negatîf ên ji pergala respirasyonê: dyspnea bi gelemperî çêdibe.
Ji pergala cardiovascular
Di zexta xwînê de, xwîna navxweyî davêje. Di pir nexweşan de: thromboembolism, isrişa ishemîk, angina pectoris, rîska bilind a enfeksiyonê myocardial. Bi kêmasî: vekirina hemorrajiya kraniocerebral, rijandina xwînê, xwîna kûrdar di xwînê gastrointestinal de, ku sedema mirinê ne.
Bandora li ser kapasîteya kontrolkirina mekanîzmayên
Li ser vexwendina bandora mimkun a derman li ser giraniya baldar tune. Tête pêşniyar kirin ku heke nexweş xwedî bandorên aliyê pergalê nerva navendî, bêhnvedanên psîkomotor bike ji ajotinê û xebitîna bi mekanîzmayên tevlihev.
Berî ku ducanek nû ya dermankirinê (her 14 rojan), divê testek xwînê were kirin.
Berî ku ducanek nû ya dermankirinê (her 14 rojan), divê testek xwînê were kirin. Derman bi tenê di cîhê nexweşxaneyê de ji bo bersivê bi demî nîşanên dehydration, perforasyonê dîwarên di xeta gastrointestinal de tê rêve kirin.
Nexweşên ku bi 2 pûan an jî pirtûka wan tenduristiya gelemperî heye, xeterek encamên neyînî hene. Ew hewce ne ku ji bo tespîtkirina bi demkî ya xirabûna tenduristî çavdêriya bijîşkî ya domdar.
Damezrandina fistulên bêyî ku li cîhê wan bibin nîşana ji bo bidawîbûna tavilê ya dermanê ye. Ev qedexe ye ku di dermankirina nexweşên ku bi navbeynkariya gîştî ya berfireh de hatine bikar anîn derman bikar bînin (heta ku birîn bi tevahî baş bibin).
Jin û mêrên temenê zarokbûnê divê piştî şeş mezina paşîn a Zaltrap di nav şeş mehan de (ne kêm) bikar bînin. Divê têgihîştina zarokek bête dûr kirin.
Zaltrap çareseriya hyperosmotic e. Ji berhevkirina wê karanîna dermanên ji bo cîhê intraocular dûr dike. Qedexe ye ku di çareseriyê de di laşê vitestî de werin danîn.
Di pîrbûnê de bikar bînin
Li nexweşên di koma temenê 65 salî û mezin de rîskek pir mezin heye ku diyardeya tîrêjê ya dirêj, dizî, kêmbûna giraniya lezgîn û dehydration be. Divê dermankirina Saltrap bi tenê di bin çavdêriya karmendên bijîşkî de were kirin. Di nîşana yekem a xerîb an dehydration de, dermanek bilez ya dermanî bilez hewce ye.
Divê dermankirina Saltrap bi tenê di bin çavdêriya karmendên bijîşkî de were kirin.
Di dema ducaniyê û laktasyonê de bikar bînin
Daneyên li ser karanîna Zaltrap di jinên ducanî û şîrê de nîne.
Ji ber ku rîskên mumkunî yên bandorên neyînî li ser zarokan hene, ji bo van kategoriyên nexweşan dermanek antî-dermanî nayê derman kirin.
Agahdariya li ser naveroka dermanê çalak a ku di şîrê dayikê de tê derxistin tune ye? Ger hewce be, di dermankirina penceşêrê de jinek nermalavê de bikar bîne, divê lactation betal bibe.
Hilberîner
Sanofi-Aventis Deutschland GmbH, Germany
Terapiya dermanê Tumor
Bandorên antitumor ên vîtamînan
Ksenia, 55 salî, Moskova: “Kursa Zaltrap ji bo dermankirina penceşêrê ji bavê min re hat şandin. Derman baş e, bandor, lê zehf zehf e. Her gav nîşanên alî hene. Baş e ku meriv di 2 hefteyan de yek carî tête îdare kirin, ji ber ku piştî kemoterapiyê, rewşa bavê her dem bi demkî xirabtir dibe, lê testên di kêmkirina neoplazmeyê de trendek erênî nîşan da. "
Eugene, 38 salî, Astana: "Min ji Zaltrap gelek bandorên nehf kir. Rewş bi hêsanî tirsnak bû: bêhn, bêhnok, serêşiya domdar, qelsiya giran. Lê derman zû zû li ser kumuşê tevdigerin. Bandora karanîna wê di dermankirina kanserê de hêja ye ku ji vê êşê xelas be. "
Alina, 49 salî, Kemerovo: "Ev dermanek giran e, û dewlet jî piştî ku kemoterapî bi wî re ye wisa ye ku ez naxwazim bijîm. Lê ew bandor e. Di 1 kursê de, tumora min hema hema winda bû. Bijîşkan got ku şansê reaksiyonê heye, lê sedî hindik e. Berê Zaltrap dermanên din dihatin bikar anîn, lê bandor bandor kurt bû, û piştî vê yekê ez 3 salan carek bê nîşanên penceşêrê dijîm. "
Zaltrap injectable

Berî ku hûn dest bi vegirtina vê dermanê bikin, doktorê xwe li ser dermanên ku jixwe hatine bikar anîn, şekirên parêzê (mînak, vîtamîn, supasên xwezayî, hwd.), Reaksiyonên alerjîk, nexweşiyên heyî, û rewşa tenduristiya heyî (mînakî ducaniyê, kirrûbirra pêşîn, hwd.) Vebêjin.
Bandorên nexşeyê yên derman dikare di rewşek taybetî ya laşê we de bêtir diyar bibin. Dermanê wek ku ji hêla doktorê we ve hatî şandin an rêve bikin û rêwerzên ji bo karanîna dermanê bişopînin. Dozê derman bi rewşa we ve girêdayî ye. Heke guhertin tune an rewşa we xirabtir e ji doktorê xwe bêjin.
Xalên girîng ên ku hûn bi peydakiroxên tenduristiya xwe re nîqaş bikin li jêr têne destnîşankirin.
- Li nexweşên pîr ji nêzik ve ji bo diyarde û dehydration çavdêriyê bikin
Zêdetir fêr bibin: Pêşniyar û rêzikên karanîna
Ji bo wergirtina vê agahdariyê, ji kerema xwe bi bijîjk, dermanxana xwe re şêwir bikin an agahdariya li ser pakijkirina hilberê bixwînin.
Zaltrap Injectable di vebijarkên jêzêdanê yên jêrîn de di pakêtên jêrîn de heye
Zaltrap Packaging Injectable Available: 4MG
Derman ji hêla pargîdaniyên jêrîn ve têne hilberandin
- Ma dema destûrdayîna vê dermanê destûr e ku amûrên pîşesaziya giran xebitîne? Heke hûn Zaltrap Injectable bigirin dema ku hûn Zaltrap Injectable bigirin, hûn bi xewnekêş, dizî, hîpotension, an serêşiyek hest dikirin, wê hingê dibe ku hûn hewce ne ku dev ji ajotinê û alavên pîşesaziya giran berdin.
Divê heke hûn derman ji we re xewn, dizî, an hîpoteza zêde bike divê hûn ji ajotinê berdin. Doktor pêşniyar dikin ku karanîna alkolê bi dermanên wusa rawestînin, ji ber ku alkol girîngî dide bandorên aliyî û xewê zêde dike. Ji kerema xwe gava ku hûn Zaltrap Injectable bikar bînin van bandorên li ser laşê xwe kontrol bikin.
Ji bo şîreta ku taybetmendiyên laş û tenduristiya gelemperî digirin, ji doktorê xwe re şîret bikin. Ma ev derman (hilberê) kesek an addictive ye? Piraniya narkotîk ne nîgaşî û nefret in.
Di pir rewşan de, dewlet dermanên ku dikarin dermanan wekî dermanên ku hatine desteserkirin-kontrolkirî, kategorîze dike. Mînakî, li Hindistanê grafika H an X û grafîka II-V li DY. Ji kerema xwe agahdariya li ser pakkirina dermanê bixwînin da ku hûn vê dermanê ku wekî bêkêmasî nehatiye damezrandin.
Wekî din, xwe ji xwe derman nekin û laşê xwe bi dermanan nekin bêyî ku hûn bi doktorê xwe re şîret bikin. Ma gengaz e ku meriv wê gav bavêje, an ez hewce dikim ku hêdî hêdî dosiyanê kêm bikim? Ji ber bandora başbûnê divê hin dermanên hanê bi hêdî bêne birrîn.
Ji bo ku hûn taybetmendiyên laş, tenduristiya gelemperî û dermanên din ên ku hûn digirin, bi doktorê xwe re şîret bikin.
Ger we doza duyemîn bala xwe kişand, wê zû zû bigirin. Ger serdanek din nêz e, hûn dikarin randevûya berê bişopînin û berdewam bikin ku hûn nexşeya xweya dermanê ya normal bişopînin. Dozek zêde neynin da ku ji bo dozek biberîn çêbikin.
Heke hûn vê rewşê bi rêkûpêk re rû bi rû dibin, li ser bîranînên sazkirinê bifikirin an ji endamek malbata xwe bipirsin ku hûn gavavêtinê bişopînin.
Bawer bikin ku hûn bi doktorê xwe re têkilî daynin da ku hûn nexşeyê ji bo dermanên windabûyî derman bikin.
- Dozê pêşniyaztir ji me zêde nekin. Bikaranîna zêde ya derman dê rewşa we aloztir neke, û ev jî dikare bibe sedema poşmanî û bandorên ciddî. Heke hûn di derbarê we de zêdebûna Zaltrap Injectable dizanin, bi karûbarên lezgîn re, nexweşxaneya herî nêzîk an nexweşxaneyê têkilî daynin.
Pê bawer bin ku pakkirin, konteyner an navê dermanan bînin jibo ku hêsankirina ducaniyê. Dermanên xwe ji kesên din re derbas nekin, hetta ew di heman rewşê de ne ku hûn in, an ji we re xuya dike ku şertên we hejmarek nîşanên hevbeş in, ji ber ku ev dikare bibe sedema zêdebûna dozekê.
- Amadekariyên li germahiya odeyê, li cîhek sar û dûr ji tîrêjê rasterê dûr bigirin. Ger hewceyek wusa di rêwerzan de nayê peyda kirin amadekarîyên ji serbest nekin. Dermanan ji heywan û zarokan dûr bikin.
Heke ev pêdivî bi hûrgulî di rêwerzan de nayê peyda kirin amadekarî nekevin nav pergalên tûjkirinê an kêşandinê. Dermanên bi vî rengî têne rijandin dikare zerareke girîng bide hawîrdorê.
Ji bo bêtir agahdarî li ser betalkirina Zaltrap Injectable, bi peydakiroxên tenduristiya xwe re têkilî daynin.
- Dibe ku dozek vegirtî ya yek Zaltrap jî dikare encamên cidî derxe holê. Heke hûn hîs an qewîn dibin bila bi doktorê xwe şêwir bikin. Wekî din, dermanek qediyayî dikare di şerê li dijî nexweşiya we de bandora xwe winda bike.
Ji bo ewlehiya xwe biparêzin, zehf girîng e ku hûn dermanên qediyayî red bikin.
Heke hûn bi nexweşiyek ku hewceyê dermanên domdar (nexweşiya dil, konvansiyon, reaksiyonên alerjî yên xeternakirî yên jiyanê) dike, pêdivî ye ku hûn kanalek pêbawer a danûstendinê bi dermanvanê xwe re damezrînin da ku bi domdarî dermanek nû ya dermanên nû bi jiyanek mayînde normal hebe.
Ji kerema xwe ji pisporê lênihêrîna tenduristî an dermanvanek xwe re şêwir bikin, û di heman demê de li agahdariya li ser pakijkirina hilberê binêrin.
- Dailymed LABEL: ZALTRAP-ziv-çareseriya aflibercept, tevnegerin https://dailymed.nlm.nih.gov/d rojmed/dr… - Gihîştina gihîştî: 12-ê Octoberirî 2016.
- Hilbijarkên NHS. Heke ku ez dozek ji antîbîotîkan winda bikim divê ez çi bikim? - Gihîştina destkeftî: 14ê Tîrmeha 2016an.
- Tu carî dozek dermanê xwe winda nakî? - Gihîştina destkeftî: 3yê Tîrmeha 2016an.
- Cancer.Net (2014).
Girîngiya Dermanê Xwe Bi Rastî - Destpêkirin: Tîrmeh 3, 2016.
Dîrokên Dirêjiya Dermanê - Ma Wateya Tiştek? - Gihîştina gihîştî: 1-ê Gulana 2016-an.
Citation of Chicago Style
- "Zaltrap Injectable - Bikarhêner, Bandirên Niştimanî, Nerazîbûn, Berhevkirin, Danûstandin, Pêşniyar, ,areserkirin û Dosage - Sanofi Aventis Us - TabletWise - USA" Tabletwise. Gihîştim Cotmeh 02, 2018. https://www.tabletwise.com/us-ru/zaltrap-injectable.
Ev rûpel agahî ji bo peyda dike Zaltrap di Russian de de Injectable.